Die Metallbindung |
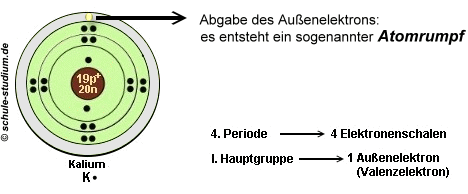
Bei der Metallbindung gibt jedes Metallatom von seinen Außenelektronen (Valenzelektronen) mindestens eins ab. Die übriggebliebenen unvollständigen Atome(vergleichbar mit einem Metallion) werden Atomrümpfe genannt.
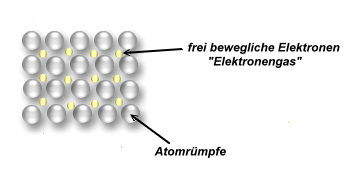
Viele Atomrümpfe ordnen sich zu einem Gitter an. In einem Metall können die existierenden Elektronen keinem Atomrumpf zugeordnet werden. Sie sorgen wie ein Klebstoff für den Zusammenhalt der Atomrumpfschichten.
Viele Eigenschaften der Metalle können durch den Aufbau sehr leicht
verständlich gemacht werden:
z. B. die elektrische Leitfähigkeit: 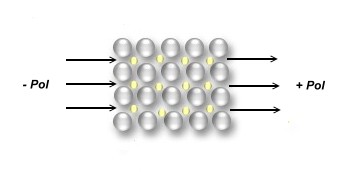
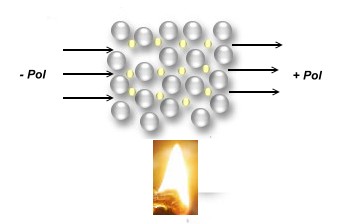
abnehmende Leitfähigkeit bei Erhitzen eines Metalls, denn "hüpfende" Atomrümpfe versperren dem Elektronengas
den Weg. Dadurch steigt der elektrische Widerstand des Metalls |
 |
Aufgrund des metallischen Aufbaus können sich die frei beweglichen
Elektronen (das sogenannte Elektronengas) mit
unglaublicher Geschwindigkeit durch die Elektronenkorridore bewegen.
