Das Wassermolekül
(gewinkelt)

(gewinkelt)

Das Kohlendioxid Molekül (linear) |
Das Kohlenmonoxid Molekül |
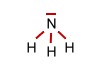
| Das Ammoniak
Molekül (trigonal-pyramidal) |
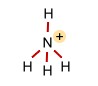
Das Ammonium-Ion (tetraedrisch) |
||
 |
 |
Das Stickstoffmonoxid-Molekül |
|||
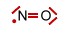 <-> <-> |
|||
Das Blausäure Molekül (HCN) |
|||||||
|
|||||||
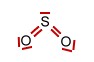
Das Schwefeldioxid -Molekül |
|||
 <-> <->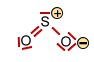 <-> <->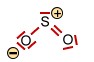 |
|||
Das Ozon -Molekül (gewinkelt) |
|||
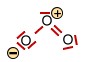 <-> <->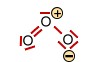 |
|||
Das Stickstoffdioxid -Molekül (gewinkelt) |
|||
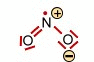 <-> <->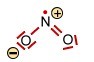 |
|||
Das Distickstofftetraoxid -Molekül (rechts) |
|||
2 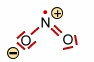 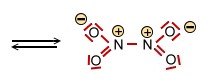 |
|||
Das Hydronium-Ion (verantwortlich für den pH-Wert) |
|||
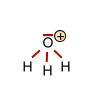 |
|||
Das Formaldehyd Molekül |
|||
Das Methan-Molekül (tetraedrisch) |
|||
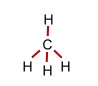 |
|||
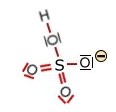
Kohlensäure und deren Ionen (trigonal planar) |
||||||
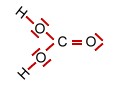 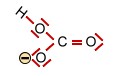 + H+
+ H+ 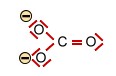 +
2H+ +
2H+
|
||||||
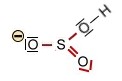
Die Salpetersäure HNO3 und deren Nitration (trigonal planar) |
||||
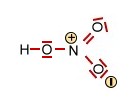 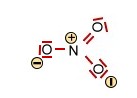 + H+
+ H+ |
||||
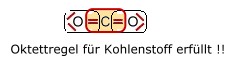
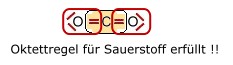
VORGEHENSWEISE: WIE ERSTELLE ICH DIE LEWIS-SCHREIBWEISE EINZELNER MOLEKÜLE??? 1. Überprüfung, ob die Duett - bzw. Oktettregel für die jeweiligen Atome erfüllt ist. Zunächst einmal sollte man wissen, dass Atome der 2. Periode sich miteinander verknüpfen, um ein Elektronenoktett zu erreichen. Insofern sind Verbindungen, bei denen die Oktettregel nicht erfüllt wird, höchst unwahrscheinlich. Betrachten wir hierzu einmal das Kohlenstoffdioxid Molekül:
Kohlendioxid hat in obiger Elektronenanordnung den erwünschten Edelgaszustand (vollbesetzte äußere Elektronenschale) für alle beteiligten Atome erfüllt. Man sagt auch die Oktettregel ist erfüllt. In einem zweiten Schritt ist aber nun zu prüfen, ob die Zahl der Valenzelektronen stimmt. 2. Überprüfung der Zahl der Valenzelektronen und eventueller Ladungen falls notwendig. Valenzelektronen einzelner Atome... Die Anzahl der Valenzelektronen, die jedes einzelne Atom in einer Verbindung hat, wird durch die Hauptgruppe angegeben. Wasserstoff, 1. Hautpgruppe -> 1 Valenzelektron; Kohlenstoff, 4. Hauptgruppe -> 4 Valenzelektronen; Stickstoff, 5. Hauptgruppe -> 5 Valenzelektronen ; Sauerstoff, 6. Hauptgruppe -> 6 Valenzelektronen; Die Zahl der Valenzelektronen eines jeden einzelnen Atoms in einer Verbindung sollte nach Möglichkeit eingehalten werden. Sollte dies aber, um die Oktettregel zu erfüllen, nicht möglich sein, so werden Ladungen Bei Kohlenstoffdioxid ebenso wie bei der nachfolgenden Blausäure (HCN)sind keine Ladungen notwendig, da keins der Atome eine überhöhte und verminderte Zahl von Valenzelektronen aufweist.
Im Falle der Blausäure (HCN) hat Wasserstoff folglich 1 VE, Kohlenstoff also 4 VE und Stickstoff 5 VE. auch der Edelgaszustand = Oktettregel ist erfüllt... -> Die Duettregel ist für Wasserstoff erfüllt (eine vollbesetzte, mit 2 Elektronen besetzte 1. Elektronenschale) -> Die Oktettregel ist für Kohlenstoff und Stickstoff erfüllt, denn beide Atome im Molekül HCN werden von 8 Elektronen umgeben. Wird die Zahl der Valenzelektronen in einer Verbindung von einem einzelnen Atom überschritten, so erhält dieses, wie bereits gesagt, eine negative Ladung bzw. im umgekehrten Fall eine positive Ladung. z.B. wie in
Hier wird die Zahl der Valenzelektronen überschritten, so dass positive und negative Ladungen gesetzt werden müssen. -> Trainings-/Übungstipp: Verschiedene Übungen und Aufgaben der Uni Paderborn zum Lösen... |