| Eigenschaften: |
- bildet Nebel an der
Luft
-
zerstört sehr schnell Haut und Gummi
-
reagiert mit Wasser
stark
sauer
-
ätzend |
| Verwendung: |
Herstellung von Stickstoffdüngern,
Sprengstoffen, Farbstoffen und Kunststoffen
|
| Strukturformel. |
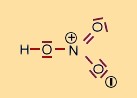 |
Stickstoff steht in der 5.
Hauptgruppe und hat somit 5 Außenelektronen (Valenzelektronen).
Gemäß der
Lewis Schreibweise verfügt es über ein Elektronenpaar
sowie über 3 einzelne Valenzelektronen. Somit kann sich Stickstoff
mit 3 Wasserstoffatomen verknüpfen.
 |
| |
Strukturformeln wichtiger Stickstoff-Sauerstoffverbindungen:
|
|
|
|
Nitration |
Stickstoffdioxid |
Stickstoffmonoxid |
| |
|
|
2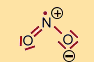 |
|
|
|
| Ostwald-Verfahren: |
- Temperatur
über 800°C
- Katalysator ist ein feinmaschiges Netz aus Platin und Rhodium-Legierungen
N2+ 3 H2
 2
NH3 2
NH3
|
