
 |
Elektronegativität
und Bindungstyp |
|
| Wie ermittle ich den Bindungstyp in einer chemischen Verbindung mit Hilfe der EN-WERTE ??? |
| Summenformel | Strukturformel | |
Bindungstyp |
Begründung |
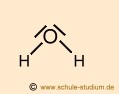 |
 |
polare Elektronen- paarbindung |
Da die |
|
 |
 |
Ionenbindung |
Da die |
|
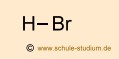 |
 |
polare Elektronen- paarbindung |
Da die |
|
 |
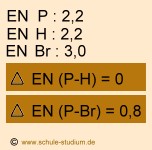 |
Bindung P-H: unpolare Elektronen- paarbindung Bindung P-Br: polare Elektronen- paarbindung |
Hier muss unterschieden werden zwischen der Bindung P-H bzw. der Bindung
P-Br. Die Bindung P-Br ist polar, weil die Die Bindung P-H ist unpolar, weil die |
|
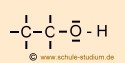 |
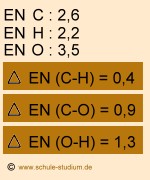 |
Bindung C-H: unpolare Elektronen- paarbindung Bindung C-O: polare Elektronen- paarbindung Bindung O-H: polare Elektronen- paarbindung |
Hier muss unterschieden werden zwischen der Bindung C-H, der Bindung
C-O bzw. der Bindung O-H. Die Bindung C-H ist unpolar, weil die Die Bindung C-O ist polar, weil die Die Bindung O-H ist polar, weil die |
|
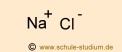 |
 |
Ionenbindung | Da die |
|
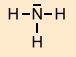 |
 |
polare Elektronen- paarbindung |
Da die |
|
| -> Chemie Kopiervorlagen /-> Physik Kopiervorlagen / -> Biologie Kopiervorlagen (Wichtige Themengebiete kurz, prägnant und gut zusammengefasst) |
© www.schule-studium.de -> Chemie Unterricht -> Chemische Reaktionen -> Unterrichtsmaterial (Sek.) -> Unterrichtsmaterial (GS ) -> Wissensbücher GS/Sek. 1 |
Schule-studium.de - Fachbereich Chemie Das Schulportal der Pfalz mit vielen Infos rund um Schule und Studium: Chemie Lernhilfen, diverse Unterrichtsmaterialien wie Chemie Arbeitsblätter, Chemie Kopiervorlagen, Chemie Arbeitsmaterialien, Arbeitsmittel, Chemie Stundenblätter, fertige Chemie Unterrichtsstunden für die Schule u.v.m. -> Themenbereich "Ernährung & Gesundheit/Nahrungsergänzung" Unterrichtsmaterialien zu den naturwissenschaftlichen Fächern finden Sie hier: >Chemie Arbeitsblätter > Physik Arbeitsblätter > Biologie Arbeitsblätter |